化合物
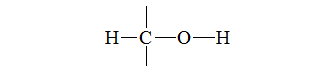 |
化合物(Chemical compound)是由兩種或兩種以上的元素以固定的質量比通過化學鍵結合在一起的化學物質。像甲烷[1] (CH4)、葡萄糖(C6H12O6)、硫酸鉛(PbSO4)及二氧化碳(CO2)都是化合物。
化合物是純物質分類下的一類,與元素和混合物相對。儘管有些情況下化合物的實際情況會與上述定義背離,如組成元素隨製備方法而改變,內部結構並不均一,不同核素的分布並不固定等等,但一般仍認為它們屬於化合物的範疇。另外,化合物中各元素的摩爾比並不一定是整數,某一元素也可呈不同的價態,例如非整比化合物和混合價態化合物。
化學元素的單質即使由幾個原子形成雙原子分子或多原子分子(如H2,S8),也不是化合物。
除特別不活潑的稀有氣體氖外,其他所有穩定元素都已製成了化合物。稀有氣體化合物的製備曾費了一些周折。第一個稀有氣體化合物六氟合鉑酸氙是在1962年才製備而得。
目錄
有機化合物與無機化合物
化合物的基本特性
化合物有以下的基本特性:
分子化合物與離子化合物
化合物主要也可分為分子化合物和離子化合物,兩者的物理性質有較大的差異:
- 分子化合物是由分子形成的化合物,分子內各原子以共價鍵相連接,分子之間存在分子間作用力(凡得瓦力、氫鍵...等)。大部份分子化合物不是導體,其沸點較低,常溫下可能是液體、固體或是氣體。像水、二氧化碳、甲烷、葡萄糖都是分子化合物。
- 離子化合物是由金屬原子及非金屬原子所形成的,金屬元素為陽離子,提供電子給非金屬元素形成的陰離子(或包括非金屬元素的酸根),氯化鈉即為離子化合物,離子化合物的特性也很類似氯化鈉,包括沒有展性、固體時會形成晶體、高沸點及熔點、只有在液態或水溶液中才會導電等特性等。
化合物和混合物的比較
化合物和混合物不同。化合物的物理性質和化學性質和組成的元素不同,而混合物物理性質和化學性質和組成的成份有關,這是化合物和混合物的主要差異。例如氯為黃綠色有毒的氣體,鈉為有金屬光澤的固體,二者都很容易反應,但組成的氯化鈉(食鹽)為無色或白色晶體,是很穩定的化合物。
另一個區分化合物和混合物的方式是混合物的成份可以用較簡單的物理方式分離,例如過濾、蒸發、使用磁力或其他方式分離,但化合物的組合成份只能用化學反應才能分離。相對的,混合物用物理的方式即可產生,但要製備化合物,需要用組成元素進行化學反應,或是將其他化合物進行化學反應才能製備。
除了金屬互化物之外的合金都是混合物,但有時會被誤認為化合物。合金是利用物理方式產生,一般是將組成的金屬加熱到液態,混合後再冷卻而得。另外類似化合物的混合物包括鹼金屬的液氨溶液。
相態
所有化合物都可以固態存在,以分子存在的化合物大多存在液態、氣態形式,有些甚至可以等離子體存在,超臨界流體的物質也可以存在,如超臨界態的二氧化碳,它較常態的二氧化碳有更強的溶解性。
只要加熱的溫度足夠高,所有化合物都會分解,生成更簡單的化合物甚至相應的單質。如:
- NH4Cl -> NH3 + HCl
- 2H2O -> 2H2 + O2
化學鍵
所謂化學鍵,即是一化學反應發生時,原子之間彼此鍵結的型式,一般常見的有共價鍵、離子鍵、金屬鍵。
- 離子鍵:當共價鍵鍵結形成之分子,原子間若電負性差在1.7以上時(電負性為原子吸引電子的能力),造成空間中電荷密度分布不均,電子會被吸引到電負性較大的原子那一方,由於吸引電子,故電負性大的原子表現出類似帶負電的特性,反之,電負性小的原子表現出類似正電荷的性質。含有離子鍵的化合物如:氧化鋁、氯化錳。
綜合上述,若化合物中的原子電負性差小於1.7,則為共價鍵,若電負性差大於1.7,則為離子鍵。
- 金屬鍵:金屬原子大部分電負性小,故沒有將價電子保留在自己原子核周圍的能力,造成電子四處游離,當大量金屬原子聚集,大量游離的電子會在規則排列的金屬原子核間四處移動不受限制,這種大量電子游離的樣貌被稱為電子海,藉由電子海及金屬原子核彼此之間的作用力,即稱為金屬鍵。金屬互化物中的原子就是因金屬鍵而結合。
- 范德華力:一般被認為是原子間交互作用的結果,但實際上並未發生化學反應,該鍵有多種型式,鍵結力量弱,其中之一為氫鍵,顧名思義,即氫原子在空間中與其他原子彼此交互作用而形成的范德華鍵。由於其能量較低,一般會歸類為分子作用力,不屬於化學鍵。
氧化態
化學式
化學式表示化合物的最基本組成。只有純物質才有化學式,混合物則沒有。根據不同的形式差異,廣義的化學式又可分為分子式、化學式、電子式、結構式、實驗式(又稱最簡式)、鍵線式(又稱骨架式)等等。
若是化合物以分子的形式存在,一般會用分子式為其化學式,若是礦物、金屬氧化物或是鹽類,一般會用實驗式為其化學式。
化學式中元素的順序一般會依排列。其體系中一般碳原子會放在化學式的最前面,後面是氫原子,其他元素則依照字母順序排列。若化合物中沒有碳,則包括氫在內的所有元素都依照字母順序排列。不過仍有一些化合物不依照此原則,例如離子化合物的陽離子一定放在前面,後面是陰離子,而氧化物的氧通常都放在後面。
有機酸的化學式一般也會依照希爾體系,碳和氫原子放在前面,例如三氟乙酸的化學式為C2HF3O2。不過三氟乙酸的結構簡式CF3CO2H可以表示較多的資訊。
一般無機化合物不會以結構式來表示,像硫酸的化學式為<chem>H2SO4</chem>,但其中沒有氫-硫鍵,若用類似結構式的方式,可以表示為<chem>O2S(OH)2</chem>,其中可以表達更多的資訊,但幾乎沒有人用這様的方式寫硫酸的化學式。