酸
 |
酸(acid有時用「HA」表示)的傳統定義是當溶解在水中時,溶液中氫離子的濃度大於純水中氫離子濃度的化合物。換句話說,酸性溶液的pH值小於水的pH值(25℃時為水的pH值是7)。酸一般呈酸味,但是品嘗酸(尤其是高濃度的酸)是非常危險的。酸可以和鹼發生中和作用[1] ,生成水和鹽。酸可分為無機酸和有機酸兩種。
目錄
酸的定義
酸在化學中主要有以下三種定義:
食物中的酸
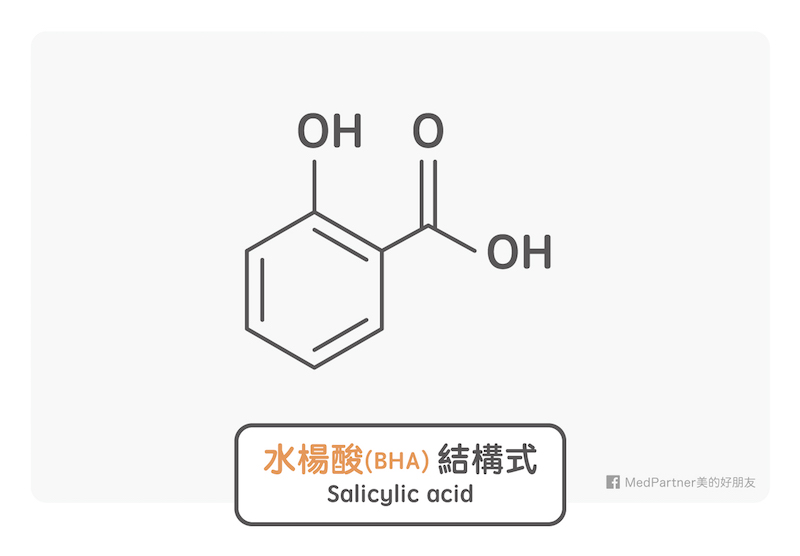
所有存在於天然食物中的有機酸都是弱酸。
酸性與氫離子的關係
所有酸在水溶液中,在特定條件下,可以產生可供化學反應的(水合)氫離子H3O+,從而表達出酸性。這包括兩類情形:
- 常見的易溶酸如H3PO4,在溶液中電離產生H3O+:
- H3PO4 + H2O → H3O+ + H2PO4−
難溶酸如H4SiO4,其溶於水的分子亦可電離產生H3O+:
- H4SiO4 + H2O → H3O+ + H3SiO4−
電離產生的H3O+可與鹼發生化學反應。當酸充分強時,電離產生的H3O+濃度大,可與活潑金屬反應產生氫氣,或與特定的鹽發生複分解反應。
- 某些酸如H3BO3,Al(OH)3,溶於水的分子本身不能電離產生H+。它們作為路易斯酸體現酸性,即,與水電離產生的OH-結合,釋放水電離產生的H3O+參與反應,從而表達出酸性:
- H3BO3 + 2H2O → H3O+ + B(OH)4−
- Al(OH)3 + 2H2O → H3O+ + Al(OH)4−
純水電離產生的H3O+與OH-濃度相同。酸性物質溶於水的分子將以上述兩類方式之一造成H3O+濃度上升,超過OH-濃度。酸溶液的H3O+離子濃度愈高,其酸度就愈高。
依電離氫離子數目分類
- HCl → H+ + Cl −
- HNO3 → H+ + NO3−
- HNO2 → H+ + NO2−
- H2SO4 → 2H+ + SO42−
- H2SO3 → 2H+ + SO32−
- H2CO3 → 2H+ + CO32−
- H3PO4 → 3H+ + PO43−
- H8C6O7 → 3H+ + H5C6O73−
除一元酸以外的酸都稱為二元酸或多元酸。
濃酸的危險性
- 濃酸常有強烈腐蝕性,有些還伴有其他特性,如具有強氧化性和脫水能力的濃硫酸,能對人體造成嚴重的化學燒傷。
- 濃酸的特性:
- 濃氫氯酸含35%氯化氫分子,濃度約為11M,是無色液體,具高度揮發性和腐蝕性。
- 濃硝酸含70%HNO3分子,濃度約為16M,是無色液體(但很多時候因有分解反應令濃硝酸溶有紅棕色的二氧化氮),具高度揮發性,易分解出有毒的二氧化氮氣體,硝酸有極強氧化性,因此造成極強腐蝕性。自我分解反應如下:4 HNO3 → 2 H2O + 4 NO2 + O2
- 濃硫酸含98%硫酸分子,濃度約為18M,是無色油狀液體,不具揮發性,但具極強的腐蝕性、氧化性和脫水性。
處理濃酸要注意的地方
常見的無機酸
強酸
強酸是指在水溶液中完全電離的酸(硫酸這類多元酸不在此限),或以酸度系數的概念理解,則指pKa值< −1.74的酸。這個值可以理解為在標準狀況下,氫離子的濃度等同於加入強酸後的溶液濃度。
大部分強酸均是腐蝕性的,但當中亦有例外。例如超強酸當中的碳硼烷酸(H(CHB11Cl11),其酸性比硫酸高百萬倍,但卻完全不帶有腐蝕性;相反,弱酸當中的氫氟酸(HF)卻帶有高度腐蝕性。它能夠溶解極大部分的金屬氧化物,諸如玻璃及除了銥以外的所有金屬。
- HA(aq) + H2O(l) → H3O+(aq) + A−(aq)
一般酸不會在水中完全離解,因此多以化學平衡而不是完全反應的形式表示,弱酸就是指不完全離解的酸。用酸度系數作為區別強酸與弱酸的作用並不明顯(因為數值差距較難理解及不明顯),因此用方程式去區別兩者更為合理。
由於強酸在水溶液中完全離解,因此氫離子在水中的濃度等同於將該酸帶到其他的溶液當中:
- [HA] = [H+] = [A−];pH = −log[H+]
酸性強度的判別
除了透過計算pH值來衡量不同酸的強度外,透過觀察以下的性質也可以判別出不同類別的酸的強度:
- 電負性:在同一元素周期下其共軛鹼的負電性愈高,它的酸度就愈高。
- 原子半徑:原子半徑增加,其酸度也會增加。以氫氯酸及氫碘酸為例,兩者均是強酸,在水中均會電離出100%的相應離子。但是氫碘酸的酸度比氫氯酸要強,這是因為碘的原子半徑遠大於氯的原子半徑。帶有負電荷的碘陰離子擁有較離散的電子雲,因此與質子(H+)的吸力較弱,因此,氫碘酸電離(去質子化)的速度更快(二者酸性的差別可在酸性更強的溶劑,如乙酸中測出,因為在乙酸中二者均只能部分電離而可體現出差別)。
- 電荷:電離後的物質愈帶有正電荷,就愈高酸度。因此中性離子較陰離子容易放出質子,陽離子也比起其他分子均具有更高酸度。
常見強酸
(從強到弱)
- 高氯酸HClO4
- 氫碘酸HI
- 氫溴酸HBr
- 氫氯酸HCl
- 硫酸H2SO4(Ka1/只限於第一酸度係數)
- 硝酸HNO3
- 水合氫離子H3O+或H+。為方便起見,通常會以H+取代H3O+。但要注意的是,單獨而孤立的質子在帶有極性的水中不可能存在,而是常與水分子的其中一對孤偶電子對結合。這使在水合氫離子中的氧的形式電荷為+1。
- 一些化學家將氯酸(HClO3),溴酸(HBrO3),高溴酸(HBrO4),碘酸(HIO3),和高碘酸(HIO4)也列為強酸,但是沒有被公認。
超強酸
超強酸通常指酸性比純硫酸更強的酸。簡單的超強酸包括三氟甲磺酸(CF3SO3H)和氟磺酸(FSO3H),它們的酸性都是硫酸的上千倍。在更多的情況下,超強酸不是單一純淨物而是幾種化合物的混合物。
超強酸這一術語由詹姆斯•布萊恩特•科南特(James Bryant Conant)於1927年提出。喬治•安德魯•歐拉因其在碳正離子和超強酸方面的研究獲得1994年諾貝爾化學獎。
常見的超強酸(從最強到最弱):
- 氟銻酸HFSbF5 (1990) (pKa值= -28)
- 魔酸FSO3HSbF5 (1974) (pKa值= -25)
- 碳硼烷酸H(CHB11Cl11) (1969) (pKa值= -18.0)
- 氟磺酸FSO3H (1944) (pKa值=-15.6)
- 三氟甲磺酸CF3SO3H (1940) (pKa值=-14.6)
- 固體超強酸 SbF5-SiO2-Al2O3,SbF5-TiO2-SiO2 (pKa值= = -13.75 ~ -14.52)
- 高氯酸 (pKa值=-13)
- 純硫酸 (pKa值=-11.93)
註:pKa值,哈米特酸度函數