螯合作用
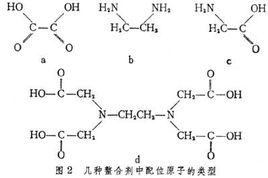
螯合作用(Chelation)指化學反應中金屬離子以配位鍵與同一分子中的兩個或更多的配位原子(非金屬)連結而形成含有金屬離子的雜環結構(螯環)的一種作用。類似蟹鉗的螯合作用,故名。螯環的形成使螯合物比組成和結構相近的非螯合絡合物具有更大的穩定性,這種由螯合作用引起的增加穩定性的效應稱為螯合效應。例如,乙二胺與金屬離子的螯合物就比氨的金屬絡合物穩定得多,而二乙基三胺的金屬螯合物因同時形成兩個螯環則更為穩定。[1]
 |
分類
絡合物包括的範圍很廣,品種繁多,但按其結構形式主要可分作幾類:
(1)簡單配位化合物。這一類是由單基配位體與中心離子簡單配位形成的絡合物如FeCl3等。這些絡離子在溶液中能逐級解離生成一系列配位數不同的絡離子。
(2)多核絡合物。如果一個配位體中一個或兩個配位原子同時同兩個中心離子絡合,從而使絡合物內界含有兩個或兩個以上的中心離子,這樣的絡合物稱為多核絡合物。
(3)螯合物。由中心離子和多基配位體絡合生成具有環狀結構的絡合物稱為螯合物。如二乙二胺合銅絡離子。
根據現代科學實驗現已確認在水溶液中大多數金屬離子都能同水分子或其它離子(包括無機的和有機)的生成各種類型的絡合離子,只有少數幾種鹼金屬鹽如鹵化物、硝酸鹽和氯酸鹽在稀溶液情況下才是呈簡單自由離子。由此可見,水溶液中溶質絡合物形態的現象十分普遍。
定義
同一配體中兩個或兩個以上配位原子與同一個中心原子間的配位成環過程。
特點
螯合作用是指金屬等中心元素能形成螯合物的過程。人體內所攝取的無機鐵之中,實際上被吸收的只有2-10%而已,將礦物質變成可被消化的形態時,通常都加上氨基酸,使它變成「螯狀」的化合物。由中心離子和某些合乎一定條件同一多齒配位體的兩個或兩個以上配位原子,鍵合而成具有環狀結構的配合物的過程稱為螯合作用。
簡介
一分子或兩分子的官能團與金屬離子之間,通過配位作用生成環狀構造的化學反應,稱為螯合作用,亦稱螯環化或環合作用。人體內所攝取的無機鐵之中,實際上被吸收的只有2-10%而已,將礦物質變成可被消化的形態時,通常都加上氨基酸,使它變成「螯狀」的化合物。首先,Chelation,意思是將礦物性物質處理成可消化的形態。普通的礦物質產品,如骨粉、白雲石(dolomite)等,幾乎都還未經「螯合」處理過。所以,在消化過程中,首先必須經過「螯合」處理。但是,大多數人體內自然地將礦物質形成「螯合」化合物(chelate compound)的過程並不能順利進行。所以,礦物質補品幾乎都不能發揮其效用。由此我們知道,人體所攝取的物質並不能完全發揮其功效。大多數人體內並不能將食物有效地消化吸收,在其所涉的無機鐵之中,實際上被消化的只有2%-10%,有50%會排泄出體外,所以人體對已經「螯合」處理過的礦物質的消化吸收比沒有處理的高3-10倍。即使多花一些錢,也是值得的。
絡合作用
通常由一個「簡單」的正離子和一定數目的中性分子或負離子以配位鍵結合起來的化學質點,稱為締合離子或絡合分子。由絡合離子或絡合分子組成的化合物稱為絡合物(有時把綜合離子也稱絡合物,二者無嚴格區別)。絡合物的組成一般分為內界和外界兩個部分。中心離子和配位體所組成的稱為絡合物的內界,在絡合物化學式中一般用方括號表示內界方括號以外的部分為外界。例如 [Cu(NH4)4]SO4。中心離子是絡合物的核心部分,它位於絡離子中心,多是帶正電荷的離子(絕大多數是金屬離子)與中心離子絡合的離子(或分子)稱為配位體。配位體中提供自由電子對的原子稱為配位原子,配位原子大都是非金屬原子。在絡合離子中與中心離子以配位鍵結合的配位原子的數目稱為配位數。在一個配位體中含有配位原子的數目稱為配位體基數。
參考文獻
- 移至 ↑ 什麼是螯合反應?具體的機理是什麼搜狗問問