由離子檢視原始碼討論檢視歷史
| 離子 |
 |
離子是指原子由於自身或外界的作用而失去或得到一個或幾個電子使其達到最外層電子數為8個或2個的穩定結構。這一過程稱為電離。電離過程所需或放出的能量稱為電離能。與分子、原子一樣,離子也是構成物質的基本粒子。
基本信息
中文名 離子
外文名 ion
基本概念
在化學變化中,原子或原子團得失電子後形成的帶電微粒稱作離子。帶正電的稱為陽離子,帶負電的稱為陰離子。
原子是由原子核和核外電子構成,原子核帶正電荷,繞核運動的電子則帶相反的負電荷。原子的核電荷數與核外電子數相等,因此原子顯電中性。如果原子從外獲得的能量超過某個殼層電子的結合能,那麼這個電子就可脫離原子的束縛成為自由電子。
原子核外第一層不能超過2個電子,次外層不超過18個。最外層最多只能排8個。
一般最外層電子數小於4的原子、或半徑較大的原子,較易失去電子(一般為金屬元素,如:鉀K,鈣Ca等)趨向達到相對穩定結構;而最外層電子數不少於4的原子(一般為非金屬元素,如:硼B,碳C等)則較易獲得電子趨向達到相對穩定結構。
當原子的最外層電子軌道達到飽和狀態(第一周期元素2個電子、第二第三周期元素8個電子)時,性質最穩定,一般為稀有氣體(氦除外,最外層有2個電子,性質也很穩定)。
離子是指原子由於自身或外界的作用而失去或得到一個或幾個電子使其達到最外層電子數為8個(如第一層是最外層,則為2個,若是氫離子,則沒有外層電子)的穩定結構。這一過程稱為電離。電離過程所需或放出的能量稱為電離能。
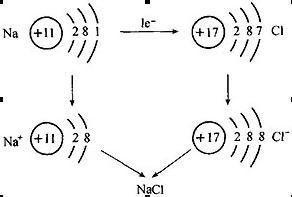
在化學反應中,金屬元素原子失去最外層電子,非金屬原子得到電子,從而使參加反應的原子或原子團帶上電荷。帶電荷的原子叫做離子,帶正電荷的原子叫做陽離子,帶負電荷的原子叫做陰離子。陰、陽離子由於靜電作用而形成不帶電性的化合物。
與分子、原子一樣,離子也是構成物質的基本粒子。如氯化鈉就是由氯離子和鈉離子構成的。
分類 當原子得到一個或幾個電子時,質子數小於核外電子數,且質子數=核外電子數-所帶電荷數,從而帶負電荷,稱為陰離子。
當原子失去一個或幾個電子時,質子數大於核外電子數,且質子數=核外電子數+所帶電荷數,從而帶正電荷,稱為陽離子。
絡離子是指由某些分子、原子或陽離子通過配位鍵與電中性分子或陰離子形成的複雜離子,例如水合離子。絡離子本身可以屬於陽離子或陰離子。
屬性 在化合物的原子間進行電子轉移而生成離子的過程稱為電離,電離過程所需或放出的能量稱為電離能。電離能越大,意味着原子越難失去電子。 離子化合物,即陰、陽離子間以離子鍵組成的化合物,如可溶於水的酸、鹼、鹽,當在水中溶解並電離時,恆定條件下,處於離子狀態的比例和處於分子狀態的比例達到動態平衡,稱為離子平衡(ion balance)。
結構示意 離子結構示意圖與原子結構示意圖一樣,人們可以用離子結構示意圖來表示離子的核電荷數和電子層排布。小圈和圈內的數字分別表示原子核和核內質子數,弧線表示電子層,弧線上的數字表示該層的電子數。當然,在書寫離子結構的時候需要注意離子核外電子一般為8電子(或2電子)的穩定結構。
發現簡史
1887年,28歲的阿侖尼烏斯在前人研究的基礎上提出了電離理論。但他的導師,著名科學家塔倫教授不認同他的觀點,嚴厲抨擊了他的論文,結果電離學說在數年後才受到公認。阿侖尼烏斯榮獲1903年諾貝爾化學獎。後來物理學家德拜對離子作了進一步研究並獲得1936年諾貝爾化學獎。等離子態與氣體放電:在絕對溫度不為零的任何氣體中。
氣體元素離子
都有一定數量的原子被電離。在氣體放電過程中以及受控聚變裝置產生的高溫等離子體中,有大量的工作氣體原子和雜質原子被剝離了最外層電子,成為離子。例如氧原子,若失去一個電子記作OⅡ,若失去兩電子記作OⅢ,以此類推。
檢驗
離子檢驗指的是通過用指示劑、沉澱、冒泡等方法鑑別離子的過程。
金屬離子 金屬離子是某種物質溶於水後的金屬元素的離子。簡單的說就是分子組成的物質中的金屬元素。絕大部分金屬離子是陽離子,但IVB-VIII族金屬可以生成陰離子。金屬離子是維持多相體系的滲透平衡的重要組成部分,也是廣泛的酶反應的必要組成部分。有些酶類的催化活性,除了蛋白質部分外,還需要金屬離子,即金屬離子是酶活性中心的組成部分。
有些酶的分子中雖不含有金屬,但需要金屬離子激活。金屬離子是酶的輔基或激活劑,金屬離子通過自身化合價的變化來傳遞電子,完成生物體內的氧化還原反應,在維持生物體內的水和電解質平衡等方面亦需要金屬離子。
非金屬離子 注:
符號
離子符號:在元素符號右上角表示出離子所帶正、負電荷數的符號。 例如,鈉原子失去一個電子後成為帶一個單位正電荷的鈉離子用"Na+"表示。硫原子獲得二個電子後帶元素符號:統一採取該元素的拉丁文名稱第一個字母來表示元素的符號(往往正負電的數字寫在正負號的前面)。
離子鍵
離子鍵 :使陰、陽離子結合成化合物的靜電作用。
離子鍵是由電子轉移(失去電子者為陽離子,獲得電子者為陰離子)形成的。即正離子和負離子之間由於靜電引力所形成的化學鍵。離子既可以是單離子,如Na、Cl;也可以由原子團形成;如SO4,NO3等。離子鍵的作用力強,無飽和性,無方向性。離子鍵形成的礦物總是以離子晶體的形式存在。
研究認為,在分子或晶體中的原子決不是簡單地堆砌在一起,而是存在着強烈的相互作用。化學上把這種分子或晶體中原子間(有時原子得失電子轉變成離子)的強烈作用力叫做化學鍵。鍵的實質是一種力。所以有的又叫鍵力,或就叫鍵。
礦物都是由原子、分子或離子組成的,它們之間是靠化學鍵聯繫着的。
化學鍵主要有三種基本類型,即離子鍵、共價鍵和金屬鍵。
共價鍵的形成
強,有飽和性與方向性。因為只有自旋方向相反的電子才能配對成鍵,所以共價鍵有飽和性;另外,原子軌道互相重疊時,必須滿足對稱條件和最大重疊條件,所以共價鍵有方向性。共價鍵又可分為三種:
1.非極性共價鍵形成共價鍵的電子云正好位於鍵合的兩個原子正中間,如金剛石的C-C鍵。
2.極性共價鍵 形成共價鍵的電子云偏於對電子引力較大的一個原子,如Pb-S 鍵,電子云偏於S一側,可表示為Pb→S。
3.配價鍵 共享的電子對只有一個原子單獨提供。如Zn-S鍵,共享的電子對由鋅提供,Z:+ ¨..S:=Z n→S 共價鍵可以形成兩類晶體,即原子晶體共價鍵與分子晶體。原子晶體的晶格結點上排列着原子。原子之間有共價鍵聯繫着。在分子晶體的晶格結點上排列着分子(極性分子或非極性分子),在分子之間有分子間力作用着,在某些晶體中還存在着氫鍵。
凝固成液氯、液氨和乾冰(二氧化碳的晶體)。說明在分子之間還有一種作用力存在着,這種作用力叫做分子間力(范德華力),有的叫分子鍵。分子間力的分子的極性有關。分子有極性分子和非極性分子,其根據是分子中的正負電荷中心是否重合,重合者為非極性分子,不重合者為極性分子。 分子間力包括三種作用力,即色散力、誘導力和取向力。
(1)當非極性分子相互靠近時,由於電子的不斷運動和原子核的不斷振動,要使每一瞬間正、負電荷中心都重合是不可能的,在某一瞬間總會有一個偶極存在,這種偶極叫做瞬時偶極。由於同極相斥,異極相吸,瞬時偶極之間產生的分子間力叫做色散力。任何分子(不論極性或非極性)互相靠近時,都存在色散力。
(2)當極性分子和非極性分子靠近時,除了存在色散力作用外,由於非極性分子受極性分子電場的影響產生誘導偶極,這種誘導偶極和極性分子的固有偶極之間所產生的吸引力叫做誘導力。同時誘導偶極又作用於極性分子,使其偶極長度增加。從而進一步加強了它們間的吸引。
(3)當極性分子相互靠近時,色散力也起着作用。此外,由於它們之間固有偶極之間的同極相斥,異極相吸,兩個分子在空間就按異極相鄰的狀態取向,由於固有偶極之間的取向而引起的分子間力叫做取向力。由於取向力的存在,使極性分子更加靠近,在相鄰分子的固有偶極作用下,使每個分子的正、負電荷中心更加分開,產生了誘導偶極,因此極性分子之間還存在着誘導力。
總之,在非極性分子之間只存在着色散力,在極性分子和非極性分子之間存在着色散務和誘導力,在極性分子之間存在着色散力、誘導力和取向力。色散力、誘導力和取向力的總和叫做分子間力。分子間力沒有方向性與飽和性,鍵力較弱。
特徵
離子是組成離子型化合物的基本粒子。離子型化合物在任何狀態下(晶體、熔融狀態、蒸氣狀態或溶液中)都是以離子的形式存在的。因此,離子的性質在很大程度上決定着離子化合物的性質。就是說,離子的性質,即離子的三種重要特徵:離子的電荷、離子的半徑、離子的電子層結構的類型(簡稱離子的電子構型)是決定離子型化合物的共性和特性的根本原因。
(1)離子的電荷
離子電荷對於離子的性質以及所組成的離子型化合物的性質,都有很大影響。即使是同一種元素,當形成不同電荷的離子時,由它們所組成的離子型化合物的性質也會有較大的差異。例如,鐵元素能形成Fe、Fe兩種離子,這兩種離子及其化合物在性質上就大不相同。Fe比Fe的正電荷多,在一定條件下,Fe能奪取1個電子變成Fe,而相反,Fe則有失去1個電子變為Fe的傾向。Fe在溶液中能跟SCN離子作用生成血紅色的Fe(SCN)離子,而Fe則不發生這種反應;Fe在水溶液里呈黃色,Fe在水溶液里卻呈淺綠色等。
(2)離子的電子構型
離子的電子層結構類型不同,對離子化合物的性質亦有一定的影響,例如,Na和Cu離子的電荷數相同,都是+1價的離子,它們的離子半徑也很相近,Na的半徑是0.095 nm,Cu的半徑是0.096 nm,但它們相應的化合物的性質卻有較大的差別:如NaI易溶於水,而CuI不易溶於水。這主要是由於Na的電子構型(2sp)和Cu的電子構型(3spd)很不相同。
(3)離子的半徑
原子或離子的絕對大小是無法確定的,因為原子核外電子並非在固定的軌道上運動。而通常說的離子半徑是指離子的有效半徑,它是通過各種結構分析實驗測定兩個異號離子A和B所組成的離子型化合物的核間距d求算出來的。而d等於A的半徑r1與B的半徑r2之和,即
d=r1+r2
由此可見,離子半徑只能近似地反映離子的大小,離子半徑隨配位數、離子的價數等等而改變。
離子半徑求算時,必須假設某個離子的r1為已知,然後依據r2=d-r1公式求出r2。1926年,戈爾德施米特由晶體結構數據確定了氟離子和氧離子的半徑分別是0.133 nm和0.132 nm,然後以此為基準,一一推算出其他各離子的半徑。
定義一:描述離子大小的參數。取決於離子所帶電荷、電子分布和晶體結構型式電荷、電子分布和晶體結構型式。設r陽為陽離子半徑,r陰為陰離子半徑。r陽+r陰=鍵長。r陽/r陰與晶體類型有關。可從鍵長計算離子半徑。一般採用Goldschmidt半徑和Pauling半徑,皆是NaCl型結構配位數為6的數據。Shannon考慮了配位數和電子自旋狀態的影響,得到兩套最新數據,其中一套數據,參考電子云密度圖,陽離子半徑比傳統數據大14pm,陰離子小14pm,更接近晶體實際。 定義二:反映離子大小的一個物理量。離子可近似視為球體,離子半徑的導出以正、負離子半徑之和等於離子鍵鍵長這一原理為基礎,從大量X射線晶體結構分析實測鍵長值中推引出離子半徑。離子半徑的大小主要取決於離子所帶電荷和離子本身的電子分布,但還要受離子化合物結構型式(如配位數等)的影響,離子半徑一般以配位數為6的氯化鈉型晶體為基準,配位數為8時,半徑值約增加3% ;配位數為4時,半徑值下降約5%。負離子半徑一般較大,約為1.3~2.5埃;正離子半徑較小,約為0.1~1.7埃。根據正、負離子半徑值可導出正、負離子的半徑和及半徑比,這是闡明離子化合物性能和結構型式的兩項重要因素。
常見離子
陽離子 1.簡單陽離子
鋁離子
Al³+
鋇離子 Ba²+ 鈹離子
Be²+
銫 離子
Cs+
鈣離子
Ca²+
鉻離子(II)
Cr²+
鉻離子(III)
Cr³+
鉻離子(VI)
Cr6+
鈷離子(II)
Co²+
鈷離子(III)
Co³+
亞銅離子(I)
Cu+
銅離子(II)
Cu²+
鎵 離子
Ga³+
氦離子
He
α個子
氫離子
H+
質子
亞鐵離子(II)
Fe²+
鐵離子(III)
Fe³+
鉛離子(II)
Pb²+
鉛離子(IV)
Pb4+
鋰離子
Li+
鎂離子
Mg²+
錳離子(II)
Mn²+
錳離子(III)
Mn³+
錳離子(IV)
Mn4+
錳離子(VII)
Mn7+
汞離子(II)
Hg²+
亞鎳離子(II)
Ni²+
鎳離子(III)
Ni³+
鉀 離子
K+
銀 離子
Ag+
鈉離子
Na+
鍶離子
Sr²+
亞錫離子(II)
Sn²+
錫離子(IV)
Sn4+
金離子
Au²+
鋅 離子
Zn²+
展開 2.多原子陽離子
銨根離子
NH₄+
水合氫離子
H₃O+
硝鎓離子
NO₂ˉ
亞汞(I)
Hg+
陰離子 1.簡單陰離子
名稱
化學式
合稱
砷離子
As³+
砷化物
疊氮根離子 N³ˉ 疊氮化物 溴離子
Brˉ
溴化物
氯離子
Clˉ
氯化物
氟離子
Fˉ
氟化物
氫負離子
Hˉ
氫化物
碘離子
Iˉ
碘化物
氮離子
N³ˉ
氮化物
氧離子
O²ˉ
氧化物
磷離子
P5ˉ
磷化物
硫離子
S²ˉ
硫化物
過氧根離子
O₂²ˉ
過氧化物
2. 含氧酸根
名稱
化學式
合稱
砷酸根離子
AsO₄³ˉ
砷酸鹽
亞砷酸根離子 AsO₃³ˉ 亞砷酸鹽 硼酸根離子
BO₃ˉ
硼酸鹽
溴酸根離子
BrO₃ˉ
溴酸鹽
次溴酸根離子
BrOˉ
次溴酸鹽
碳酸根離子
CO₃²ˉ
碳酸鹽
碳酸氫根離子
HCO₃ˉ
碳酸氫鹽
氫氧根離子
OHˉ
氫氧化物
氯酸根離子
ClO₃ˉ
氯酸鹽
高氯酸根離子
ClO₄ˉ
高氯酸鹽
亞氯酸根離子
ClO₂ˉ
亞氯酸鹽
次氯酸根離子
ClOˉ
次氯酸鹽
鉻酸根離子
CrO₄²ˉ
鉻酸鹽
重鉻酸根離子
Cr₂O₇²ˉ
重鉻酸鹽
碘酸根離子
IO₃ˉ
碘酸鹽
硝酸根離子
NO₃ˉ
硝酸鹽
亞硝酸根離子
NO₂ˉ
亞硝酸鹽
磷酸根離子
PO4ˉ
磷酸鹽
亞磷酸根離子
HPO₃ˉ
亞磷酸鹽
磷酸一氫根離子
HPO₄ˉ
磷酸一氫鹽
磷酸二氫根離子
H₂PO₄ˉ
磷酸二氫鹽
錳酸根離子
MnO₄²ˉ
錳酸鹽
高錳酸根離子
MnO₄ˉ
高錳酸鹽
硫酸根離子
SO₄²ˉ
硫酸鹽
硫代硫酸根離子
S₂O₃²ˉ
硫代硫酸鹽
硫酸氫根離子
HSO₄ˉ
硫酸氫鹽
亞硫酸根離子
SO₃²ˉ
亞硫酸鹽
亞硫酸氫根離子
HSO₃ˉ
亞硫酸氫鹽
過硫酸根離子
S₂O8²ˉ
過硫酸鹽
硅酸根離子
SiO₄²ˉ
硅酸鹽
偏硅酸根離子
SiO₃²ˉ
偏硅酸鹽
鋁硅酸根離子
AlSiO₄ˉ
鋁硅酸鹽
展開 3. 有機酸根離子
名稱
化學式
合稱
乙酸根(醋酸根)離子
CH₃COOˉ
乙酸鹽
甲酸根離子 HCOOˉ 甲酸鹽 草酸根離子
(COO)²ˉ 或 C₂O₄²ˉ
草酸鹽
草酸氫根離子
HOOCCOOˉ 或 HC₂O₄ˉ
草酸氫鹽
4. 其他陰離子
名稱
化學式
合稱
硫化氫根離子
HSˉ
硫化氫鹽
碲離子 Te²ˉ 碲化物 氨基負離子
NH₂ˉ
氨基鹽
氰酸根離子
OCNˉ
氰酸鹽
硫氰酸根離子
SCNˉ
硫氰酸鹽
氰離子
CNˉ
氰化物
常見顏色 名稱
化學式
顏色
高錳酸根離子
MnO₄ˉ
紫色
錳酸根離子 MnO₄²ˉ 綠色 鉻酸根離子
CrO₄²ˉ
黃色
重鉻酸根離子
Cr₂O₇²ˉ
橙色
銅離子
Cu²+
藍色
亞銅離子
Cu+
紅色
鐵離子
Fe²+
黃色
亞鐵離子
Fe³+
淡綠色
亞鈷離子
Co+
粉紅色
錳離子
Mn²+
淡粉紅色
溴離子
Brˉ
淡黃色
離子方程式
用實際參加反應的離子符號表示離子反應的式子。它不僅表示一定物質間的某個反應,而且表示了所有同一類型的離子反應的基本步驟為:
①、寫出有關反應的化學方程式。
②、可溶性的強電解質(強酸、強鹼、可溶性鹽)用離子符號表示,其它難溶的物質、氣體、水等仍用分子式表示。微溶的強電解質應看其是否主要以自由離子形式存在,例如,石灰水中的Ca(OH)₂寫離子符號,石灰乳中的Ca(OH)₂用分子式表示。
③、刪去方程式兩邊不參加反應的離子。
④、檢查式子兩邊的各種原子的個數及電荷數是否相等。
各種類型的離子方程式可按下列方法書寫:
①、珞和反應、鹽類的水解反應應直接寫離子方程式。例如,氯化鐵溶液跟硫氰化鉀溶液反應:Fe³+ + SCNˉ===Fe(SCN)₃
碳酸鈉水解:Ⅰ. CO₃²ˉ+H₂O===HCO₃ˉ+OHˉ Ⅱ . HCO₃ˉ+H₂O===H₂CO₃+OHˉ
②、簡單的複分解反應可直接寫出離子方程式。注意:當反應物一邊或生成物一邊有多種物質需用分子式表示時,應當寫全,不可遺漏。例如,氫氧化鋇與硫酸銨溶液共熱:可溶性酸式鹽跟強鹼的反應比較複雜,應按基本步驟書寫,否則易出錯誤。
③、氧化還原類型的離子反應應按基本步驟書寫,否則會出現多種錯誤。例如,鐵跟氯化鐵溶液反應,以下寫法是錯誤的(兩邊電荷不等):Fe+Fe=2Fe, 應先寫出化學方程式: Fe+2FeCl₃===3FeCl₂,再刪去未反應的Cl:Fe+2Fe³+===3Fe²+
毒性
離子液體(ILs)是完全由離子組成的在室溫或使用溫度下呈液態的鹽,一般由較大的有機陽離子和較小的無機陰離子組成。離子液體的物化性質以及應用方面已有較多報道,但有關離子液體的負面影響直到最近才引起人們的注意。有報道指出:離子液體因沒有蒸氣壓,在使用過程中本身不會形成揮發性有機物而被稱為"綠色產品",但離子液體本身並非"綠色"產品---某些離子液體甚至是有毒的。Jastorff等則指出離子液體在設計應用方面存在一定的危害,並提出應結合多學科知識對其潛在危害性進行綜合評價。從離子液體的製備、再生和處置過程看:目前用於製備離子液體的主要原料(烷基取代咪唑、烷基取代吡啶、烷基取代鹽和烷基取代銨鹽等)大多是揮發性有機物;而離子液體的再生過程主要是採用具有揮發性的傳統有機溶劑進行萃取的過程;某些離子液體本身是有毒且難以生物降解的。因此,在離子液體大規模應用前需對其應用風險進行評價。
離子液體的毒性在其對生態環境的影響與應用風險評價方面起着極其重要的作用。近年來有關離子液體毒性方面的研究卻遠遠滯後於離子液體物性及應用研究,直到最近才有少量報道。
毒性研究
離子液體毒性的相關研究,國外處於起步階段,國內尚未見相關報道。從已有研究報道看,目前的研究工作主要集中在以下兩個問題:一是ILs對生態系統中各類生物的毒性作用情況;二是ILs的各部分組成對ILs毒性的影響。ILs各組成部分對其毒性的影響主要包括如下方面: (1)陽離子核對ILs毒性的影響;(2)側鏈取代基R1、R2的長度對ILs毒性的影響;(3)陰離子對ILs毒性的影響。研究方法以生物個體水平的毒性試驗研究為主,並有少量分子、細胞水平的毒性試驗以及SAR研究。
化學術語 學科分支 無機化學 有機化學 物理化學 分析化學 理論化學 計算化學 生物化學 熱化學 電化學 光化學 藥物化學 量子化學 核化學 放射化學 天文化學 大氣化學 環境化學 綠色化學 信息化學 地球化學 石油化學 高分子化學 超分子化學 基本概念 分子 原子 元素 化學物質 化學命名法 離子 酸鹼性 氧化還原 化合物 摩爾 化學鍵 分子間力 化學反應 基本定律 質量守恆定律 能量守恆定律 電荷守恆定律 阿伏伽德羅定律 朗伯比爾定律 波義耳定律 查理定律 菲克定律 蓋呂薩克定律 亨利定律 蓋斯定律 定組成定律 倍比定律 拉烏爾定律[1]