理想氣體常數檢視原始碼討論檢視歷史
| 理想氣體常數 |
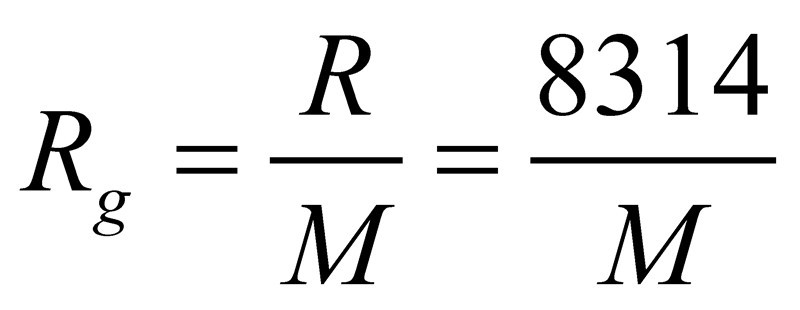 |
理想氣體常數,又名:通用氣體常數
n摩爾理想氣體在絕對溫度T,壓力P下,占有體積V則PV=nRT。此式稱為理想氣體的狀態方程,式中R即通用氣體常數,其數值與氣體種類無關,只與單位有關。Rg=R/M,M是摩爾質量,Rg是氣體常數,如氧氣的氣體常數Rg=8.314/0.032。
簡介
n摩爾理想氣體在絕對溫度T,壓力P下,占有體積V則PV=nRT。此式稱為理想氣體的狀態方程,式中R即通用氣體常數,其數值與氣體種類無關,只與單位有關。因為各種真實氣體在壓力趨近於零時都趨近於理想氣體,所以由實驗測出,當溫度為273.15K時,每摩爾任一氣體的值都是22.414L,因此,在法定計量單位中R=8.314J·mol-1·K-1。 其它表達式:p*V=m*Rg*T=m*(R/M)*T=n*R*T,其中 p 是氣體壓力,V是容積, m是氣體質量, R某一種氣體的氣體常數, T 氣體溫度, Rg 通用氣體常數, M 氣體的分子質量, n 摩爾數。
評價
對於實際氣體,R與壓力、溫度、氣體種類有關 但溫度較高、壓力較低時,R近於常數。當T 較高,p→0時,無論何種氣體,均有: R =(pVm)p→0/T=8.314472J·mol^(-1)·K^(-1)
R=8.314472cm3·MPa·mol^(-1)·K^(-1)
R=8.314472*10^3dm3·Pa·mol^(-1)·K^(-1)
R=8.314472m3·Pa·mol^(-1)·K^(-1)
R=0.0820574587L·atm·mol^(-1)·K^(-1)(atm:大氣壓)[1]