歸中反應檢視原始碼討論檢視歷史
| 歸中反應 |
 |
歸中反應就是指同種元素組成的不同物質(可以是單質和化合物,也可以是化合物和化合物)發生氧化還原反應,元素的兩種化合價向中間靠攏。歸中反應與歧化反應相對。
簡介
「歸中」即高值與低值同時向中間值靠攏。「歸中反應」就是物質某種性質的高值與低值反應生成中間值。歸中反應是中學化學中一類較為常見的反應,若能具備其思想,對於物質化學性質的掌握和化學方程式的書寫將大有裨益。
評價
氧化還原反應中的歸中反應
含有同一元素的不同價態的兩種物質發生反應,生成只含有該元素中間價態的物質的反應叫做歸中反應。
碳和二氧化碳反應【C+CO2==高溫==2CO】
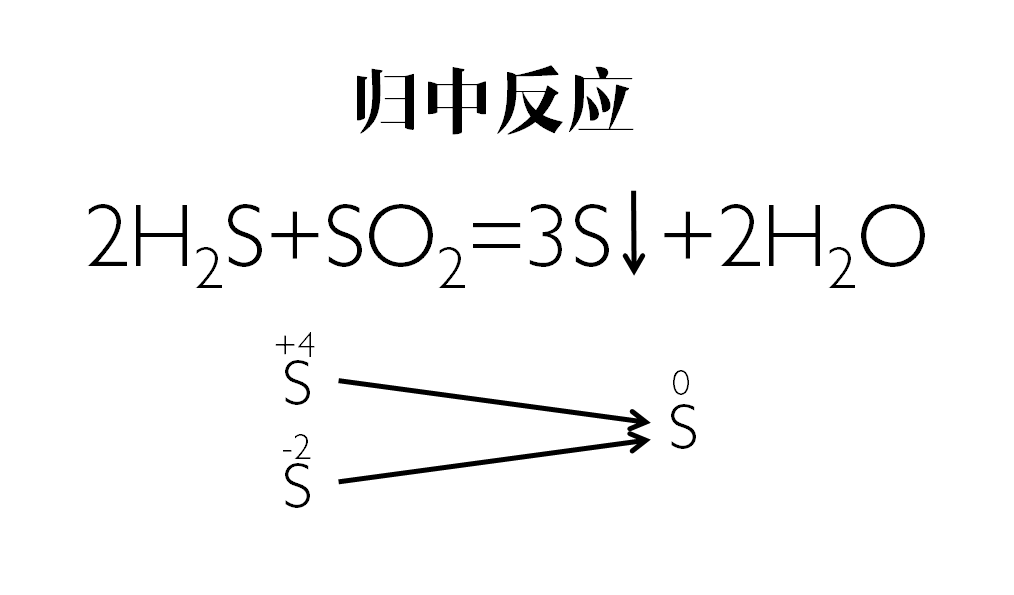
硫化氫和二氧化硫反應【SO2+2H2S====3S↓+2H2O】
硫化氫和亞硫酸反應【H2SO3+2H2S====3S↓+3H2O】
鐵和鐵離子反應【Fe+2Fe====3Fe】
次氯酸鈣和濃鹽酸反應【Ca(ClO)2+4HCl(濃)====2Cl2↑+CaCl2+2H2O】
溴的歸中【5NaBr+NaBrO3+3H2SO4====3Br2+3Na2SO4+3H2O】
銅和氧化銅反應【CuO+Cu=Cu2O】
硫化氫和濃硫酸反應(設n(H2S):n(H2SO4)=n)n=1【H2S+H2SO4====S↓+SO2↑+2H2O】(等體積)n>1【3H2S+H2SO4====4S↓+4H2O】(H2S過量)n<1【H2S+3H2SO4====4SO2↑+4H2O】(H2SO4過量)
雙水解反應中歸中反應
這類歸中反應指:能形成兩性化合物的元素所形成的兩類鹽溶液反應形成氫氧化物的反應。
這是金屬陽離子和該金屬所生成的陰離子生成中性的氫氧化物沉澱的歸中現象。
鋁【Al+3AlO2+6H2O====4Al(OH)3↓】
鋅【Zn+ZnO2+2H2O====2Zn(OH)2↓】
【高價+低價→中間價】解釋:
例:2H2S+SO2====3S↓+2H2O
此反應中,H2S中的S是-2價,SO2中的S是+4價,它們兩者發生氧化還原反應後,生成0價的S和水
其餘的歸中反應
(1) 鹼與多元酸反應:當多元酸過量時可形成酸式鹽
過量硫化氫和氫氧化鈉反應【NaOH+H2S====NaHS+H2O】
過量硫酸和氫氧化鈉反應【H2SO4+NaOH====NaHSO4+H2O】
(2) 多元酸與對應的正鹽反應
硫化鈉和硫化氫反應【Na2S+H2S====2NaHS】
碳酸鈣和碳酸反應【CaCO3+H2CO3====Ca(HCO3)2】
硫酸鈉與硫酸反應【Na2SO4+H2SO4====2NaHSO4】
亞硫酸銨與亞硫酸反應【(NH4)2SO3+H2SO3====2NH4HSO3】
磷酸鈣與磷酸反應【Ca3(PO4)2+4H3PO4====3Ca(H2PO4)2】
(3) 多元酸與對應的酸式鹽
磷酸一氫鈉與磷酸反應【Na2HPO4+H3PO4====2NaH2PO4】
(4) 正鹽與對應的酸式鹽
磷酸二氫鈉與磷酸鈉反應【NaH2PO4+Na3PO4=2Na2HPO4】
如果把正鹽和鹼中所含的可電離的氫離子看成是零,那麼生成酸式鹽的歸中條件是:兩種反應物組成上要相差兩個或兩個以上可電離的氫離子。如果兩種反應物的組成相差兩個以上可 電離的氫離子(即三元酸與對應正鹽或與鹼反應),則生成物與反應物用量有關,但符合"顯強性"原理,即生成物的組成接近於過量物的組成。
例1:磷酸與氫氧化鈉反應,設n(H3PO4):n(NaOH)=a(n表示物質的量)
a≤1,反應式【H3PO4+NaOH====NaH2PO4+H2O】
1<a<2,反應式【2H3PO4+3NaOH====NaH2PO4+Na2HPO4+3H2O】
a=2,反應式【H3PO4+2NaOH====Na2HPO4+2H2O】
2<a<3,反應式【2H3PO4+5NaOH====Na2HPO4+Na3PO4+5H2O】
a≥3,反應式【H3PO4+3NaOH====Na3PO4+3H2O】
例2:磷酸與磷酸鈉反應,設n(H3PO4):n(Na3PO4)=b(n表示物質的量)
b<1,反應式【H3PO4+2Na3PO4====3Na2HPO4】
b=1,反應式【H3PO4+Na3PO4====NaH2PO4+Na2HPO4】
b≥2,反應式【2H3PO4+Na3PO4====3NaH2PO4】 [1]