原電池檢視原始碼討論檢視歷史
| 原電池 |
 |
原電池是利用兩個電極的電勢的不同,產生電勢差,從而使電子流動,產生電流。需要注意的是,非氧化還原反應也可以設計成原電池。
簡介
原電池的發明歷史可追溯到18世紀末期,當時意大利生物學家伽伐尼正在進行著名的青蛙實驗,當用金屬手術刀接觸蛙腿時,發現蛙腿會抽搐。大名鼎鼎的伏特認為這是金屬與蛙腿組織液(電解質溶液)之間產生的電流刺激造成的。1800年,伏特據此設計出了被稱為伏打電堆的裝置,鋅為負極,銀為正極,用鹽水作電解質溶液。1836年,丹尼爾發明了世界上第一個實用電池,並用於早期鐵路信號燈。
評價
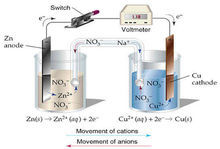
原電池的工作原理:原電池反應屬於放熱的反應,一般是氧化還原反應,但區別於一般的氧化還原反應的是,電子轉移不是通過氧化劑和還原劑之間的有效碰撞完成的,而是還原劑在負極上失電子發生氧化反應,電子通過外電路輸送到正極上,氧化劑在正極上得電子發生還原反應,從而完成還原劑和氧化劑之間電子的轉移。兩極之間溶液中離子的定向移動和外部導線中電子的定向移動構成了閉合迴路,使兩個電極反應不斷進行,發生有序的電子轉移過程,產生電流,實現化學能向電能的轉化。
但是,需要注意,非氧化還原反應一樣可以設計成原電池。
從能量轉化角度看,原電池是將化學能轉化為電能的裝置;從化學反應角度看,原電池的原理是氧化還原反應中的還原劑失去的電子經外接導線傳遞給氧化劑,使氧化還原反應分別在兩個電極上進行。
構成原理
1.電極材料由兩種金屬活潑性不同的金屬或由金屬與其他導電的材料(非金屬或某些氧化物等)組成。
2.電解質存在。
3.兩電極之間有導線連接,形成閉合迴路。
4.發生的反應是自發的氧化還原反應。
只要具備前三個條件就可構成原電池。而化學電源因為要求可以提供持續而穩定的電流,所以除了必須具備原電池的三個構成條件之外,還要求有自發進行的化學反應。也就是說,化學電源必須是原電池,但原電池不一定都能做化學電池。
形成前提:總反應為自發的化學反應。
注:新課標高中化學中所有原電池都發生了氧化還原反應,但非氧化還原反應一樣可以設計成原電池。
電極的構成 a.活潑性不同的金屬-鋅銅原電池,鋅作負極,銅作正極;
b.金屬和非金屬(非金屬必須能導電)-鋅錳乾電池,鋅作負極,石墨作正極;
c.金屬與化合物-鉛蓄電池,鉛板作負極,二氧化鉛作正極;
d.惰性電極-氫氧燃料電池,電極均為鉑。
電解液的選擇:負極材料一般要能與電解液自行發生氧化還原反應。
正負極判斷 通常情況下,在原電池中某一電極若不斷溶解或質量不斷減少,該電極發生氧化反應,此為原電池的負極(陽極,anode);若原電池中某一電極上有氣體生成、電極的質量不斷增加或電極質量不變,該電極發生還原反應,此為原電池的正極(陰極,cathode)。[1]
正極發生還原反應,得到電子;負極發生氧化反應,失去電子。
電子由負極流向正極,電流由正極流向負極。 溶液中,陽離子移向正極,陰離子移向負極。
電極判斷 負極:電子流出的一極(負極定義);化合價升高的一極;發生氧化反應的一極;活潑性相對較強(有時候也要考慮到電解質溶液對兩極的影響)金屬的一極。(僅適用於原電池)
正極:電子流入的一極(正極定義);化合價降低的一極;發生還原反應的一極;相對不活潑(有時候也要考慮到電解質溶液對兩極的影響)的金屬或其它導體的一極。(僅適用於原電池)
陽極:發生氧化反應的電極(陽極定義)
陰極:發生還原反應的電極(陰極定義)
在原電池中,外電路為電子導電,電解質溶液中為離子導電。
注意:anion是陰離子,anode是陽極,cation是陽離子,cathode是陰極。
原電池的判定 先分析有無外接電路,有外接電源的為電解池,無外接電源的可能為原電池;然後依據原電池的形成條件分析判斷,主要是"四看": 看迴路--形成閉合迴路或兩極直接接觸;
看本質--能否轉化為氧化還原反應。
2.多池相連,但無外接電源時,兩極活潑性差異最大的一池為原電池,其他各池可看做電解池。
口訣 離子不上岸,電子不下水。[1]