理想气体常数查看源代码讨论查看历史
| 理想气体常数 |
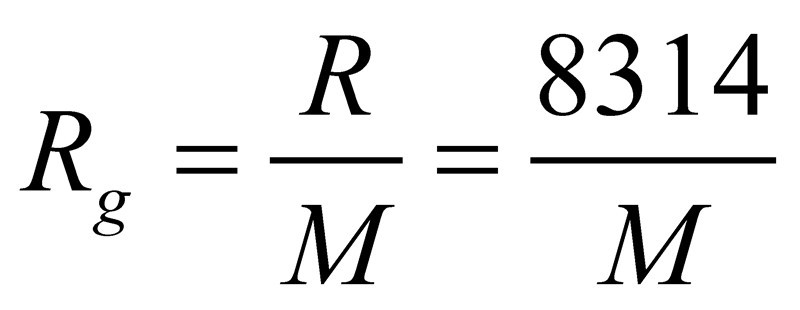 |
理想气体常数,又名:通用气体常数
n摩尔理想气体在绝对温度T,压力P下,占有体积V则PV=nRT。此式称为理想气体的状态方程,式中R即通用气体常数,其数值与气体种类无关,只与单位有关。Rg=R/M,M是摩尔质量,Rg是气体常数,如氧气的气体常数Rg=8.314/0.032。
简介
n摩尔理想气体在绝对温度T,压力P下,占有体积V则PV=nRT。此式称为理想气体的状态方程,式中R即通用气体常数,其数值与气体种类无关,只与单位有关。因为各种真实气体在压力趋近于零时都趋近于理想气体,所以由实验测出,当温度为273.15K时,每摩尔任一气体的值都是22.414L,因此,在法定计量单位中R=8.314J·mol-1·K-1。 其它表达式:p*V=m*Rg*T=m*(R/M)*T=n*R*T,其中 p 是气体压力,V是容积, m是气体质量, R某一种气体的气体常数, T 气体温度, Rg 通用气体常数, M 气体的分子质量, n 摩尔数。
评价
对于实际气体,R与压力、温度、气体种类有关 但温度较高、压力较低时,R近于常数。当T 较高,p→0时,无论何种气体,均有: R =(pVm)p→0/T=8.314472J·mol^(-1)·K^(-1)
R=8.314472cm3·MPa·mol^(-1)·K^(-1)
R=8.314472*10^3dm3·Pa·mol^(-1)·K^(-1)
R=8.314472m3·Pa·mol^(-1)·K^(-1)
R=0.0820574587L·atm·mol^(-1)·K^(-1)(atm:大气压)[1]