极性键查看源代码讨论查看历史
| 极性键 |
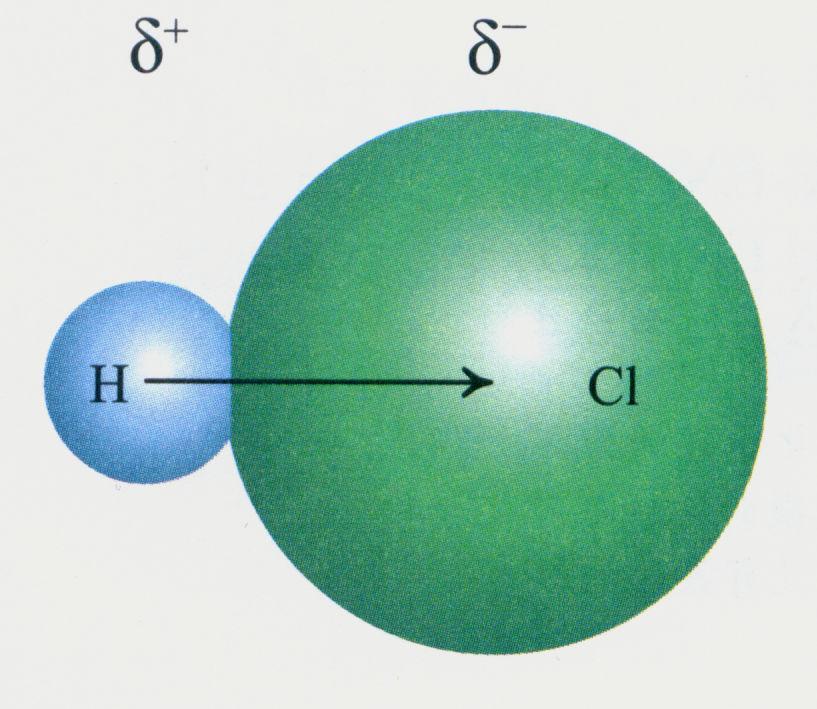 |
极性键,在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性,这样的共价键叫做极性共价键,简称极性键。
简介
按照前线轨道理论去理解,极性键的形成原因可以这样解释:由于分子轨道是由原子前线轨道线性组合而成。若A原子的电负性比B原子大,则其前线轨道能级比B原子前线轨道能级低。在形成共价键过程中,能量低的成键轨道的能级与先前的A原子前线轨道能级更接近,故此成键轨道主要由A原子的前线轨道构成;而能量较高的反键轨道能级则与原来的B原子前线轨道能级更接近,则其主要由B原子的前线轨道构成。由于电子优先分布于成键轨道,所以,电负性较大的A原子则占据了更多的电子,共价键的极性就这样产生了。
评价
如果分子的构型不对称,则分子为极性分子。
区分极性分子和非极性分子的方法:非极性分子的判据:中心原子化合价法和受力分析法。
含有极性键的分子未必是极性分子,衡量极性分子的标准为偶极距的大小,只有当偶极距不为零时,分子才具有极性。
分子中,
心原子 组成为ABn型化合物,若中心原子A的化合价的绝对值等于族的序数,则该化合物为非极性分子,如:CH4,CCl4,SO3,PCl5。
中心原子化合价的绝对值不等于原子最外层电子数时,为极性分子,如:HX(X为卤族元素),CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3CH2OH。
受力分析 若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子,如:CO2,C2H4,BF3。[1]