归中反应查看源代码讨论查看历史
| 归中反应 |
 |
归中反应就是指同种元素组成的不同物质(可以是单质和化合物,也可以是化合物和化合物)发生氧化还原反应,元素的两种化合价向中间靠拢。归中反应与歧化反应相对。
简介
“归中”即高值与低值同时向中间值靠拢。“归中反应”就是物质某种性质的高值与低值反应生成中间值。归中反应是中学化学中一类较为常见的反应,若能具备其思想,对于物质化学性质的掌握和化学方程式的书写将大有裨益。
评价
氧化还原反应中的归中反应
含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应叫做归中反应。
碳和二氧化碳反应【C+CO2==高温==2CO】
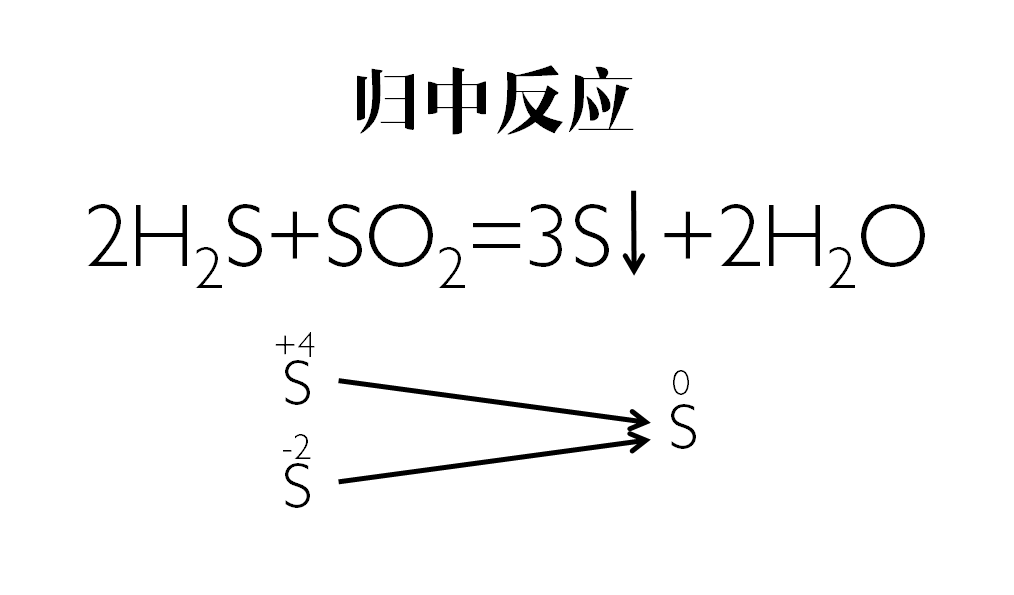
硫化氢和二氧化硫反应【SO2+2H2S====3S↓+2H2O】
硫化氢和亚硫酸反应【H2SO3+2H2S====3S↓+3H2O】
铁和铁离子反应【Fe+2Fe====3Fe】
次氯酸钙和浓盐酸反应【Ca(ClO)2+4HCl(浓)====2Cl2↑+CaCl2+2H2O】
溴的归中【5NaBr+NaBrO3+3H2SO4====3Br2+3Na2SO4+3H2O】
铜和氧化铜反应【CuO+Cu=Cu2O】
硫化氢和浓硫酸反应(设n(H2S):n(H2SO4)=n)n=1【H2S+H2SO4====S↓+SO2↑+2H2O】(等体积)n>1【3H2S+H2SO4====4S↓+4H2O】(H2S过量)n<1【H2S+3H2SO4====4SO2↑+4H2O】(H2SO4过量)
双水解反应中归中反应
这类归中反应指:能形成两性化合物的元素所形成的两类盐溶液反应形成氢氧化物的反应。
这是金属阳离子和该金属所生成的阴离子生成中性的氢氧化物沉淀的归中现象。
铝【Al+3AlO2+6H2O====4Al(OH)3↓】
锌【Zn+ZnO2+2H2O====2Zn(OH)2↓】
【高价+低价→中间价】解释:
例:2H2S+SO2====3S↓+2H2O
此反应中,H2S中的S是-2价,SO2中的S是+4价,它们两者发生氧化还原反应后,生成0价的S和水
其余的归中反应
(1) 碱与多元酸反应:当多元酸过量时可形成酸式盐
过量硫化氢和氢氧化钠反应【NaOH+H2S====NaHS+H2O】
过量硫酸和氢氧化钠反应【H2SO4+NaOH====NaHSO4+H2O】
(2) 多元酸与对应的正盐反应
硫化钠和硫化氢反应【Na2S+H2S====2NaHS】
碳酸钙和碳酸反应【CaCO3+H2CO3====Ca(HCO3)2】
硫酸钠与硫酸反应【Na2SO4+H2SO4====2NaHSO4】
亚硫酸铵与亚硫酸反应【(NH4)2SO3+H2SO3====2NH4HSO3】
磷酸钙与磷酸反应【Ca3(PO4)2+4H3PO4====3Ca(H2PO4)2】
(3) 多元酸与对应的酸式盐
磷酸一氢钠与磷酸反应【Na2HPO4+H3PO4====2NaH2PO4】
(4) 正盐与对应的酸式盐
磷酸二氢钠与磷酸钠反应【NaH2PO4+Na3PO4=2Na2HPO4】
如果把正盐和碱中所含的可电离的氢离子看成是零,那么生成酸式盐的归中条件是:两种反应物组成上要相差两个或两个以上可电离的氢离子。如果两种反应物的组成相差两个以上可 电离的氢离子(即三元酸与对应正盐或与碱反应),则生成物与反应物用量有关,但符合"显强性"原理,即生成物的组成接近于过量物的组成。
例1:磷酸与氢氧化钠反应,设n(H3PO4):n(NaOH)=a(n表示物质的量)
a≤1,反应式【H3PO4+NaOH====NaH2PO4+H2O】
1<a<2,反应式【2H3PO4+3NaOH====NaH2PO4+Na2HPO4+3H2O】
a=2,反应式【H3PO4+2NaOH====Na2HPO4+2H2O】
2<a<3,反应式【2H3PO4+5NaOH====Na2HPO4+Na3PO4+5H2O】
a≥3,反应式【H3PO4+3NaOH====Na3PO4+3H2O】
例2:磷酸与磷酸钠反应,设n(H3PO4):n(Na3PO4)=b(n表示物质的量)
b<1,反应式【H3PO4+2Na3PO4====3Na2HPO4】
b=1,反应式【H3PO4+Na3PO4====NaH2PO4+Na2HPO4】
b≥2,反应式【2H3PO4+Na3PO4====3NaH2PO4】 [1]