一抗二抗
| 一抗二抗 |
 |
| 一抗二抗 |
|
中文名稱 :一抗二抗 外文名稱 :resistance No.1、 resistance No. 全 稱 :第一抗體、第二抗體 領 域 :醫學 |
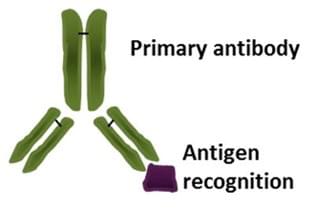
第一抗體就是能和非抗體性抗原(特異性抗原)特異性結合的蛋白。種類包括單克隆抗體和多克隆抗體。第二抗體是能和抗體結合,即抗體的抗體,其主要作用是檢測抗體的存在,放大一抗的信號。[1]
目錄
簡介
第一抗體
第一抗體就是能和非抗體性抗原(特異性抗原)特異性結合的蛋白。種類包括單克隆抗體和多克隆抗體。
第二抗體
第二抗體是能和抗體結合,即抗體的抗體,其主要作用是檢測抗體的存在,放大一抗的信號。二抗是利用抗體是大分子的蛋白質具有抗原性的性質,去免疫異種動物,由異種動物的免疫系統產生的針對於此抗體的免疫球蛋白。用抗AIV H5亞型血凝素單克隆抗體為包被抗體,兔抗AIV IgG為第二抗體。
區別
第一抗體就是平常所說的抗體,即能和抗原特異性結合。第二抗體是能和抗體結合的,即抗體的抗體。主要用於檢測抗體的存在。一抗是針對抗原的抗體,二抗是針對一抗的抗體。即抗體也可以充當抗原刺激機體產生抗體。也就是說,抗原進入機體刺激機體免疫系統產生免疫應答,由B細胞可以產生與相應抗原發生特異性結合的特殊蛋白質。一抗二抗都是一種可以特異結合別的物質的基團,而且一抗可以至少結合兩種其他基團(底物和二抗)。一抗:可以特異結合底物,就是識別出我們想要檢測的東西。一抗和底物結合與否用肉眼是看不出來的。二抗:可以和一抗結合,並帶有可以被檢測出的標記(如帶熒光、放射性、化學發光或顯色基團),作用是檢測一抗。 如果一抗自己帶有可以被檢測出的標記(如帶熒光、放射性、化學發光或顯色基團),則不需要二抗。但這樣成本很高,因為一種一抗只識別一種底物。所以如今的設計一般是二抗帶上可檢測標記,再來檢測一抗。而一抗識別底物。這樣,當一抗結合到底物上,就可以通過二抗檢測出來。
舉例
利用抗原-抗體反應原理,就是以一抗作為探針,它與目的蛋白作用並連接,再用帶有熒光(或同位素)標記的二抗與一抗作用,最後顯色,發光位置就有目的蛋白。
定義
- 指抗原與相應抗體之間所發生的特異性結合反應。這種反應既可在機體內進行,也可以在機體外進行。抗原抗體反應的過程是經過一系列的化學和物理變化,包括抗原抗體特異性結合和非特異性促凝聚兩個階段,以及由親水膠體轉為疏水膠體的變化。
- HBsAg(表面抗原)
- HBsAb(表面抗體)
- HBeAg(E抗原)
- HBeAb(E抗體)
- (核心抗體)
- 最多見的是"三抗"陽性:"抗-HBs+、抗-HBe、和抗- HBc+",這說明乙肝病毒感染結束,體內病毒清除,提示這個人免疫功能十分正常,可以獻血,也可以應用他的血製造高效價乙肝免疫球蛋門(HBIG),用於對乙肝的防治。
- 二抗陽性"即"抗-HBs+和抗-HBe+"或"抗-HBs+和抗-HBc+"
製備方法
原理
ELISA是以免疫學反應為基礎,將抗原、抗體的特異性反應與酶對底物的高效催化作用相結合起來的一種敏感性很高的試驗技術。由於抗原、抗體的反應在一種固相載體--聚苯乙烯微量滴定板的孔中進行,每加入一種試劑孵育後,可通過洗滌除去多餘的游離反應物,從而保證試驗結果的特異性與穩定性。在實際應用中,通過不同的設計,具體的方法步驟可有多種。即:用於檢測抗體的間接法(圖a)、用於檢測抗原的雙抗體夾心法(圖b)以及用於檢測小分子抗原或半抗原的抗原競爭法等等。比較常用的是ELISA雙抗體夾心法及ELISA間接法。
操作步驟
- 方法一 用於檢測未知抗原的雙抗體夾心法:
- 包被:用0.05M PH9.6 碳酸鹽包被緩衝液將抗體稀釋至蛋白質含量為1~10μg/ml。在每個聚苯乙烯板的反應孔中加0.1ml,4℃過夜。次日,棄去孔內溶液,用洗滌緩衝液洗3次,每次3分鐘。(簡稱洗滌,下同)。
- 5%脫脂乳(SMP)或者BSA 37℃(或者RT封閉)封閉1小時。棄去孔內溶液,用洗滌緩衝液洗3次,每次3分鐘。
- 加樣:加一定稀釋的待檢樣品0.1ml於上述已包被之反應孔中,置37℃孵育1小時。然後洗滌。(同時做空白孔,陰性對照孔及陽性對照孔)。
- 加酶標抗體:於各反應孔中,加入新鮮稀釋的酶標抗體(經滴定後的稀釋度)0.1ml。37℃孵育0.5~1小時,洗滌。
- 加底物液顯色:於各反應孔中加入臨時配製的TMB底物溶液0.1ml,37℃10~30分鐘。
- 終止反應:於各反應孔中加入2M硫酸0.05ml。
- 結果判定:可於白色背景上,直接用肉眼觀察結果:反應孔內顏色越深,陽性程度越強,陰性反應為無色或極淺,依據所呈顏色的深淺,以"+"、"-"號表示。也可測O·D值:在ELISA檢測儀上,於450nm(若以ABTS顯色,則410nm)處,以空白對照孔調零後測各孔O·D值,若大於規定的陰性對照OD值的2.1倍,即為陽性。[2]
- 方法二 用於檢測未知抗體的間接法:
- 用包被緩衝液將已知抗原稀釋至1~10μg/ml, 每孔加0.1ml,4℃過夜。次日洗滌3次。
- 加一定稀釋的待檢樣品(未知抗體)0.1ml於上述已包被之反應孔 中,置37℃孵育1小時,洗滌。
- 同時做空白、陰性及陽性孔對照於反應孔中,加入新鮮稀釋的酶標第二抗體(抗抗體)0.1ml, 37℃孵育30-60分鐘,洗滌,最後一遍用DDW洗滌。[3]
注意事項
- 1. 正式試驗時,應分別以陽性對照與陰性對照控制試驗條件,待檢樣品應作一式二份,以保證實驗結果的準確性。有時本底較高,說明有非特異性反應,可採用羊血清、兔血清或BSA等封閉。
- 2. 在ELISA中,進行各項實驗條件的選擇是很重要的,其中包括:
- (1) 固相載體的選擇:許多物質可作為固相載體,如聚氯乙烯、聚苯乙烯、聚丙酰胺和纖維素等。其形式可以是凹孔平板、試管、珠粒等。當前常用的是40孔聚苯乙烯凹孔板。不管何種載體,在使用前均可進行篩選:用等量抗原包被,在同一實驗條件下進行反應,觀察其顯色反應是否均一性,據此判明其吸附性能是否良好。
- (2) 包被抗體(或抗原)的選擇:將抗體(或抗原)吸附在固相載體表面時,要求純度要好,吸附時一般要求PH在9.0~9.6之間。吸附溫度,時間及其蛋白量也有一定影響,一般多採用4℃18~24小時。蛋白質包被的最適濃度需進行滴定:即用不同的蛋白質濃度(0.1、1.0和10μg/ml等)進行包被後,在其它試驗條件相同時,觀察陽性標本的OD值。選擇OD值最大而蛋白量最少的濃度。對於多數蛋白質來說通常為1~10μg/ml。
- (3)酶標記抗體工作濃度的選擇:首先用直接ELISA法進行初步效價的滴定(見酶標記抗體部份)。然後再固定其它條件或採取"方陣法"(包被物、待檢樣品的參考品及酶標記抗體分別為不同的稀釋度)在正式實驗系統里準確地滴定其工作濃度。
- (4) 酶的底物及供氫體的選擇:對供氫體的選擇要求是價廉、安全、有明顯地顯色反應,而本身無色。有些供氫體(如OPD等)有潛在的致癌作用,應注意防護。有條件者應使用不致癌、靈敏度高的供氫體,如TMB和ABTS是當前較為滿意的供氫體。底物作用一段時間後,應加入強酸或強鹼以終止反應。通常底物作用時間,以10-30分鐘為宜。底物使用液必須新鮮配製,尤其是H2O2在臨用前加入。[4]