吸氧腐蚀查看源代码讨论查看历史
| 吸氧腐蚀 |
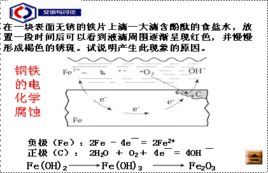 |
吸氧腐蚀是金属在空气中最普遍发生的一种腐蚀方式,在酸性、碱性和中性条件下都能发生作用。发生机理是由于金属表面有水分,后通过原电池原理发生作用,使得金属(如:钢铁)被空气中的氧气腐蚀,产生生锈,由于此过程中需要消耗氧气,故名为:吸氧腐蚀或者耗氧腐蚀。
简介
例如,钢铁在接近中性的潮湿的空气中的腐蚀就属于吸氧腐蚀。
钢铁等金属的电化腐蚀主要是吸氧腐蚀.
吸氧腐蚀的必要条件
以氧的还原反应为阴极过程的腐蚀,称为氧化还原腐蚀或吸氧腐
蚀。发生吸氧腐蚀的必要条件是:金属的电位比氧化还原反应的电位低。
吸氧腐蚀的阴极去极化剂是溶液中溶解的氧。随着腐蚀的进行,氧不断消耗,只有来自空气中的氧进行补充。因此,氧从空气中进入溶液并迁移到阴极表面发生还原反应,这一过程包括一系列步骤。
(1) 氧穿过空气/溶液界面进入溶液;
(2) 在溶液对流作用下,氧迁移到阴极表面附近;
(3) 在扩散层范围内,氧在浓度梯度作用下扩散到阴极表面;
(4) 在阴极表面氧分子发生还原反应,也叫氧的离子化反应。
评价
随着盐浓度的增加,溶液导电性增加,腐蚀速度增加;同时,随着盐量增加,氧在溶液中的所谓溶解度降低,从而降低腐蚀速度。盐量的这种双重作用导致金属腐蚀速度在某个盐浓度时出现极大值在盐浓度很低时,氧的溶解度比较大,供氧充分,此时随着盐浓度增加,由于电导率增加,吸氧腐蚀速度增加。当盐浓度进一步增加,会使溶解度显著降低,从而吸氧腐蚀速度也降低。
溶液搅拌和流速的影响
在氧浓度一定的条件按下,极限扩散电流密度与扩散层厚度成反比,溶液流速越大,扩散层厚度越小,氧的极限电流密度也就越大,腐蚀速度越大。
析氢腐蚀与吸氧腐蚀的比较[1]