自由能
| 自由能 |
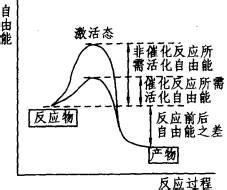 |
自由能是指在某一個熱力學過程中,系統減少的內能中可以轉化為對外做功的部分,它衡量的是:在一個特定的熱力學過程中,系統可對外輸出的"有用能量"。可分為亥姆霍茲自由能和吉布斯自由能。
計算方法:
①吉布斯自由能
G = U − TS + pV = H − TS
其中U是系統的內能,T是溫度(絕對溫度,K),S是熵,p是壓強,V是體積,H是焓。
②亥姆霍茲自由能
A = U - TS
其中 U 是系統的內能,T 是溫度,S 是熵。
目錄
簡介
自由能(free energy)在物理化學中,按照亥姆霍茲的定容自由能F與吉布斯的定壓自由能G的定義,G=A+PV (P為壓力,V為體積)。在生物的反應中,因為△(PV)可以忽略不計,所以兩者是相同的。只有這樣,A的變化△A=△U-T△S才成為主要討論的問題(U、T、S分別是該系統的內能、絕對溫度、熵)。△A給出了生物反應中釋放出來可用於做功的能量上限。其變化量(一般用△G*表示)在生物學上使用時必須注意下列事項:⑴水的活度,可隨意設為1.0進行計算:⑵因[H+]=1M並不符合實際情況,一般認為[H+]=10^(-7) M(pH=7),為了區別其符號寫成△G0′;⑶例如反應,因各種成分並非標準濃度(1M),把實際濃度代入下式後其值△G′就有問題了;⑷在共軛反應中,要注意各種成分反應的變化量之和;⑸把△G0改為用平衡常數(Keq)表示,往往是很有用的。
評價
歷史上,對"自由能"這一術語的使用在不同學科中存在不同。
化學當中,自由能指的是吉布斯自由能,以G表示,同時稱亥姆霍茲自由能為"亥姆霍茲函數",以示區別。 物理學當中,自由能指的亥姆霍茲自由能,以A表示,同時稱吉布斯自由能為"吉布斯函數",以示區別。[1]