生物成像
| 生物成像 |
 |
生物成像是了解生物体组织结构,阐明生物体各种生理功能的一种重要研究手段。它利用光学或电子显微镜直接获得生物细胞和组织的微观结构图像,通过对所得图像的分析来了解生物细胞的各种生理过程。近年来,随着光学成像技术的发展,尤其是数字化成像技术和计算机图像分析技术的引进,生物成像技术已经成为细胞生物学研究中不可或缺的方法。[1]
未来生物成像技术的发展除了进一步提高图像的分辨率外,还需要增强成像的实时性和连续性,以期实现对单个生物功能分子的体内连续追踪,详细地记录其生理过程,从而完全揭示其生物学功能。另外,生物成像技术在临床医学诊断中的应用也越来越受到重视,发展无损伤的体内成像技术是其在疾病诊断中广泛应用的重要前提。
目录
八种生物成像技术
引语
生物专栏:定期梳理生物领域发布过的好文章,总结一些专业知识,专业技能供大家参考。
材料人现在设立各种文章专栏,所涉及领域正在慢慢完善,由此也需要更多的专栏作者,期待你们的加入,有意向的小伙伴直接微信联系cailiaorenVIP。不要再犹豫,下一个专栏创始人就是你。请记住:纵然你离我千里万里,我都在材料人等你!
前言
生物成像,顾名思义,是了解生物体组织结构,阐明生物体各种生理功能的一种重要研究手段。它利用光学或电子显微镜获取生物细胞和组织的微观结构图像,用来了解生物细胞的各种生理过程。一般来说,生物成像仅仅是为了初步诊断,后续还需要利用各种治疗方式来治愈相关疾病,这个过程也就是大家经常听到的“诊疗一体化”。由于文章篇幅有限,这里先介绍生物成像,下次再讲后续生物治疗手段。那么目前生物成像方式有哪些呢?它们又各自有什么优缺点呢?又有哪些材料已经广泛应用于该成像模式?下面我们一起来看看。
荧光成像(Fluorescence imaging,FI)
2.1成像原理
FI的理论基础是荧光物质被激发后所发射的荧光信号的强度在一定的范围内与荧光素的量成线性关系。FI系统包括荧光信号激发系统(激发光源、光路传输组件)、荧光信号收集组件、信号检测以及放大系统。
成像媒介:荧光
常用仪器:
荧光分光光度计——主要用于得到荧光激发和发射光谱,荧光寿命,量子产率等数据;
激光共聚焦显微镜——主要用于细胞荧光成像;
活体成像系统——主要用于动物体内荧光成像。
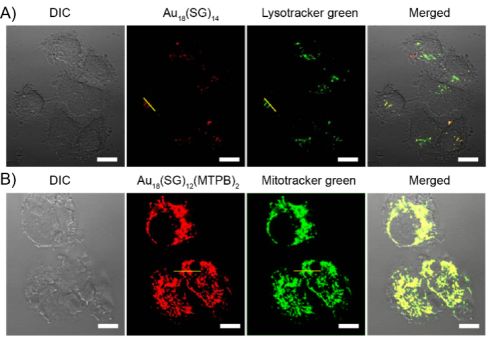
而这个发射的荧光信号的波长范围一般在可见到红外区域的居多。因为光的波长越长对组织的穿透力越强,所以对于能够发射出波长较长的近红外荧光(NIRF)的材料是我们所追求的。目前有很多荧光染料已经商业化,用于对细胞内部的各个细胞器进行染色,呈现出不同波长的发射光,从而有利于对单个生物功能分子的体内连续追踪,详细地记录其生理过程。细胞荧光成像图。
用100μg/ mL(A)Au18SG14和(B)Au18SG12MTPB2在37℃下与乳腺癌细胞共孵育1h后并分别与Lysotracker green和Mitotracker green共染色得到的共聚焦激光扫描显微镜图像。在合并的图片中,由红色和绿色信号产生的黄色斑点表示纳米团簇在溶酶体或线粒体内的共定位情况。图中所有比例尺均为20μm。[1]
2.2 优缺点
优点:成本较低,灵敏度高,可以做多色成像,操作较简单。
缺点:空间分辨率较低,组织渗透性较差,一般只能做到表层。
2.3 经典造影剂
量子点[2],比如硅量子点,锗量子点,CdS、CdSe、CdTe、ZnS、PbS、ZnSe量子点等等;
荧光染料[3],比如香豆素,荧光素,硼二吡咯甲基衍生物(BODIPY),罗丹明和花青染料(吲哚菁绿ICG,cy5等等);
镧系元素掺杂的上转换纳米颗粒[4],比如NaYF4,Y2O3,Gd2O3,NaGdF4,GdF3,CaF2,LaPO4;
荧光金属纳米团簇[5],比如谷胱甘肽或者牛血清白蛋白保护的金纳米团簇。
磁共振成像(Magnetic resonance imaging,MRI)
3.1成像原理
MRI是根据有磁距的原子核在磁场作用下,能产生能级间的跃迁的原理而采用的一项新检查技术,利用外磁场和物体的相互作用来成像。MRI系统主要由三大基本构件组成,即磁体部分、磁共振波谱仪部分、数据处理和图像重建部分。
成像媒介:磁场(无线电波)
常用仪器:磁共振扫描仪——用于体外模拟环境和活体成像
图2 Fe3+螯合的黑色素纳米粒子(MNP)的体外和体内MRI研究[6]。
(A)在琼脂糖凝胶中不同浓度的Fe-RGD-PEG-MNP在磁场为1.0T,温度25℃条件下得到的T1弛豫率(1/T1,s-1)。(B)Fe-RGD-PEG-MNP在活小鼠体内测得的MRI信号。用浓度为0,1.25,2.5(上层从左到右)和5,10,20(下层从左到右)μM的Fe-RGD-PEG-MNP对小鼠进行皮下注射(红色虚线包围的区域)。(C)对小鼠尾静脉注射RGD-PEG-MNP 4 h后与0h比较得到U87MG肿瘤增强MR信号的定量分析。(D)对小鼠尾部静脉注射250 μL,200 μM RGD-PEG-MNP前后所得到的U87MG肿瘤的MRI图像(肿瘤部位被黄色虚线圈出)。顶行显示黑白图像,底行显示伪彩色图像。
3.2 优缺点
优点:空间分辨率高,不受组织穿透能力的限制;由于是磁场成像,无放射性,对人体无害。
缺点:花费成本较高,灵敏度较低,需要成像检测时间较长,不能定量分析,T1、T2以及质子密度测量运算麻烦、可比性差。
3.3 经典造影剂
超顺磁性造影剂:Fe3O4, MnFe2O4, FeCo
顺磁纳米粒子造影剂:Gd2O3, MnO
顺磁性金属离子和配体组成的造影剂:金属离子主要为二价铁Fe2+3d6,三价铁Fe3+3d5,二价锰Mn2+3d5,三价钆Gd3+4f7镧系元素,三价镝Dy3+4f9镧系元素,Gd3+有7个未成对电子,自旋磁矩大,电场对称,弛豫效率高,易与水配位,且配位水分子为8-9个,是造影剂的较佳选择。很多文献都是优先采用Gd3+与各种配体(只要该配体富含负电子基团即可)螯合用于MRI分析[7-8]。
电子计算机断层扫描(Computed tomography,CT)
4.1 成像原理
CT是用X射线束对人体某部一定厚度的层面进行扫描,由探测器接收透过该层面的X射线,转变为可见光后,由光电转换变为电信号,再经模拟/数字转换器转为数字,输入计算机处理。CT图像是层面图像,常用的是横断面。为了显示整个器官,需要多个连续的层面图像。通过CT设备上图像的重建程序的使用,还可重建冠状面和矢状面的层面图像,可以多角度查看器官和病变的关系。CT系统主要由扫描部分(X线管、探测器和扫描架),计算机系统,图像显示和存储系统三部分组成。
成像媒介:X线束
常用仪器:CT扫描仪——用于体外模拟环境和活体成像
图3经过TAP-SiO2 @ AuNPs处理的血栓和非血栓形成模型的微型CT轴向切片,矢状切片和血栓病变部位的3D重建图像。黄色矩形表示小鼠原位血栓模型中形成的颈总动脉[9]。
4.2 优缺点
优点:空间分辨率较高,不受组织穿透力的限制
缺点:辐射风险大,不能定量分析
4.3 经典造影剂
已经用于临床的(主要基于碘化化合物)
离子型造影剂: 泛影葡胺(Angiografin),复方泛影葡胺(Urografin)或泛影钠(Hapaque);
非离子型造影剂:目前国内外均普遍建议使用非离子型造影剂,它与离子型造影剂相比具有毒性小,含碘高,副作用小和增强效果好等优点,但价格较昂贵。
碘普罗胺类:优维先(Ultravist)
碘海醇类:欧内派克(Omnipaque)
碘帕醇类:碘比乐(lopamiro)
目前处于研究阶段的新一代CT造影剂:
金纳米粒子[9],铋(Bi),镱(Yb)或金(Au)基纳米颗粒[10-12],生物小分子保护的超小金纳米团簇[13]
发射型计算机断层成像术(Emission Computed Tomography,ECT)
5.1 成像原理
ECT包括单光子发射计算机断层成像术(Single-Photon Emission Computed Tomography,SPECT)和正电子发射断层成像术(Positron Emission Tomography,PET)两种,属于核医学的两种CT技术。顾名思义,二者区别在于一个是单光子发射,一个是正电子发射。这便涉及到成像原理:SPECT成像所需要的放射性核素大多是衰变产生单一能量的γ光子即单光子,发射140KeV的低能γ光子;而PET成像所使用的是发射正电子的放射性核素,正电子是负电子的反物质,本身穿透性较弱,人体内正电子核素显像所发射的正电子不能被体外的设备探测到,设备探测的是正电子与负电子相互作用后所产生的湮灭辐射过程的高能γ光子。
ECT系统的基本结构分3部分,即旋转探头装置(专门探测γ射线)、电子线路、数据处理和图像重建的计算机系统。
成像媒介:γ射线
常用仪器:ECT扫描仪
图464Cu标记的黑色素纳米粒子(MNP)的体外和体内PET研究。
(A)64Cu-RGD-PEG-MNP分别与经过和未经过RGD预处理的U87MG细胞在37℃下孵育1,2和4小时后所得的细胞摄取率。(B)在尾静脉注射64Cu-RGD-PEG-MNP 2,4和24小时后获得的经过衰变校正的冠状(顶部)和横轴(底部)小动物PET图像(左三个图像)和U87MG肿瘤的CT(灰色)和PET(彩色)(右三个图像)的重叠图像(黄色虚线圈出的区域)。(C)在尾静脉注射64Cu-RGD-PEG-MNP 2,4和24小时后在小鼠体内的生物分布。使用在整个器官区域上绘制的感兴趣区域计算来自每个器官的放射性信号[6]。
5.2 优缺点
SPECT
优点:灵敏度高,不受组织穿透力限制
缺点:有一定辐射风险,空间分辨率较低
PET
优点:灵敏度高,特异性高,可一次性全身扫描显像,不受组织穿透力限制,可以定量分析。
缺点:有一定辐射风险(毕竟核素还是有一定放射性的,但所用剂量很少,远远小于常规CT检查),花费成本高,空间分辨率较低。
5.3 典型造影剂
放射性核素:
SPECT常用99mTc、133I、67Ga、153Sm
PET常用18F、11C、13N、15O
6.光热成像(Photothermal imaging,PTI)
6.1 成像原理
成像媒介:红外辐射能量
常用仪器:红外热成像仪
红外热像仪主要由红外探测器、光学成像物镜、光机扫描系统三大部分构成。热成像仪利用光学器件将场景中的物体发出的红外能量聚焦在红外探测器上,然后将每个探测器元件的红外数据转换成标准的图片或者视频格式,可以在标准的视频监视器上显示出来,或记录在录像带上。
(A)用氙灯照射尾静脉注射IABDP NPs后,体内含有HeLa肿瘤的裸鼠的PT图像。(B)氙灯照射下的肿瘤温度曲线[14]。
6.2 优缺点
优点:良好的温度灵敏度,可实时监测
缺点:空间分辨率较差
6.3 典型造影剂
基本上具有光热转换特性的材料都可以实现光热成像。比如,金纳米颗粒(金纳米棒,金纳米球,金纳米星等等),石墨烯以及衍生物,聚吡咯等有机物。
拉曼成像(Raman imaging,RI)
7.1 成像原理
拉曼成像技术是新一代快速、高精度、面扫描激光拉曼技术,它将共聚焦显微镜技术与激光拉曼光谱技术完美结合,作为第三代Raman技术,拉曼光谱成像上的每一个像元,都对应于一条完整的拉曼光谱,这些数百、数千甚至数百万条光谱综合在一起,就产生了一幅反映材料的成分和结构的伪彩图像。
成像媒介:拉曼散射光
常用仪器:激光共聚焦显微拉曼光谱成像系统
C12-单壁碳纳米管SWNT-抗体Her2与BT474细胞共孵育后的共聚焦拉曼光谱图像(左)(中间的是光学图像,右侧的是重叠图像)[15]。
7.2 优缺点
优点:分辨率高,扫描速度快,可避免组织自发荧光问题,可定性定量定位分析,可提供样品的化学成分、分子结构、结晶度和应变应力等重要的生化信息
缺点:受光学成像穿透深度的限制,拉曼成像方法主要适用于活体浅表以及离体组织检测;数据采集以及处理时间较长
7.3 典型造影剂
具有共振拉曼散射特性的材料:碳基纳米材料,比如单壁碳纳米管,石墨烯;贵金属纳米颗粒,比如金纳米颗粒
超声成像(Ultrasound imaging,USI)
8.1 成像原理
超声成像是利用超声声束扫描人体,通过对反射信号的接收、处理,以获得体内器官的图象。不同组织器官的反射规律不同。阵列声场延时叠加成像是超声成像中最传统,最简单的,也是目前实际当中应用最为广泛的成像方式。在这种方式中,通过对阵列的各个单元引入不同的延时,而后合成为一聚焦波束,以实现对声场各点的成像。
成像媒介:超声波
常用仪器:超声成像仪,最常用的为B超
图7 手工制作的琼脂凝胶体模用于体外US成像。在37℃的盐水中Gas-NPs的时间依赖性体外US图像。通过从幻象信号中减去水强度来对US图像进行归一化处理[16]。
图8 Gas-NPs的长期和持续的体内US肿瘤成像能力[16]。
8.2 优缺点
优点:价廉,简便,无电离辐射性,成像速度快,对软组织结构分辨率高,对比性强,实时成像,无痛苦,易被多数患者使用。
缺点:受气体与骨骼的阻碍,不适合于含气脏器的检查;诊断准确性影响因素较多,受操作者经验技巧影响,比如超声伪像是声像图畸变,易导致误诊。
8.3 典型造影剂
超声造影剂是一种含有直径为几微米气泡的液体。利用含有气泡的液体对超声波有强散射的特性,临床将超声造影剂注射到人体血管中用以增强血流的超声多普勒信号和提高超声图像的清晰度和分辨率。
第一代超声造影剂微泡内含空气,包膜一般为白蛋白或半乳糖等聚合体。
第二代超声造影剂为包裹高密度惰性气体(不易溶于水或血液)为主的外膜薄而柔软的气泡,比如全氟丙烷脂质微泡。
光声成像(Photoacoustic imaging,PAI)
9.1 典型造影剂
PAI是近年来发展起来的一种非入侵式和非电离式的新型生物医学成像方法。当脉冲激光照射到生物组织中时,组织的光吸收域将产生超声信号,我们称这种由光激发产生的超声信号为光声信号。生物组织产生的光声信号携带了组织的光吸收特征信息,通过探测光声信号能重建出组织中的光吸收分布图像。
成像媒介:超声波
常用仪器:光声计算机断层扫描和光声显微镜
不同造影剂对小鼠脑PA成像的影响的比较[17]。
9.2 优缺点
优点:比纯光学成像穿透更深(可实现70 mm的深层活体内组织成像),比传统MRI以及PET成像的分辨率更高,对人体无害,非常安全,可应用于临床。
缺点:PAI结合了超声成像和光学成像各自的优点,成为近年来最有希望发展的一种成像技术,不过也有它需要克服的难题,比如,在光声显微成像方面,如何提高光声显微成像的速度使其更加适应临床诊断以及检测等等。
9.3 典型造影剂
金属基纳米材料,碳基纳米材料,过渡金属硫属元素化物/基于MXene的纳米材料,有机小分子,半导体聚合物纳米粒子[18]。
10.总结与展望
10.1 多模态成像——优化组合,扬长避短
以上八种成像技术各有各的优点以及不足之处,因此为了更好地提高诊断效率,多模态成像成为大势所趋——正所谓八仙过海,各显神通,团结就是力量。当然也不是说八种成像技术同时运用,一方面,几乎不大可能实现,另一方面,也没那必要。一般来说,三四种成像技术的结合基本上就可以满足需求。比如,PET/CT/MRI三模态成像,一方面,PET图像以高灵敏度提供关于疾病的功能信息。另一方面,CT和MRI提供解剖信息的高分辨率图像。因此,这些不同成像模式的组合可以同时执行高灵敏度和高分辨率,并提供关于目标疾病的更详细的解剖学或生物学信息。尽管预期这些组合能够比单一成像技术提供更准确和详细的信息,但是多模态成像的合理模态的合理选择非常重要。在多模态成像组合的选择和设计过程中,研究人员应合理地禁止优势的重叠,而应补偿每种模态的弱点,以达到最大化的协同效应。这便是具有高灵敏度(PET,FI等)的成像模态经常与具有高空间分辨率(MRI,CT等)的其他成像模态组合的原因。
10.2 不同造影剂的选择与组合
尽管不同的成像技术相互补偿,但仍然存在对每种模态的不同灵敏度的担忧。例如,PET或NIRF试剂可以以极低浓度使用,而MRI和CT试剂则需要相对高的浓度。因此,有必要更多地关注组合成像剂到纳米颗粒中的量。
10.3 成像仪器的改善与优化
大部分情况下,不同成像模式是需要不同成像仪器来实现的。当需要对样品进行多种测量时,就得移动样品到多台设备上测量,这样不仅会耗时耗力,还会影响测量准确度。因此,成像仪器的改善与进步也是我们需要努力的一方面,有望通过提供少量探针的精细图像来帮助解决这些问题。比如,拉曼-荧光光谱测量系统,一台设备即可实现拉曼成像,荧光成像,光电流成像,荧光寿命成像等多种功能。无需移动样品到多台设备上测量,可以对样品同一位置进行拉曼,荧光,荧光寿命,光电流多种测量,消除样品移动造成的位置误差。
综上,八种成像技术,你最青睐哪一种,或者认为哪几种是最佳搭档?欢迎在留言区讨论,希望与各位老师同学互相指教,共同进步。作者水平有限,如有不妥,请批评指正。